Köpa Ramipril Utan Recept
- Farmakologiska egenskaper
- Indikationer
- Kontraindikationer
- Interaktion med andra läkemedel och andra former av interaktion
- Dosering och administrering
- Överdos
- Negativa reaktioner
- Bäst före datum
- Lagringsförhållanden
- Diagnos
- Rekommenderade analoger
- Handelsnamn
Förening
aktiv ingrediens: ramipril;
1 tablett innehåller ramipril 2,5 mg eller 5 mg eller 10 mg;
Hjälpämnen:
tabletter om 2,5 mg: hypromelos, mikrokristallin cellulosa (PH 112), mikrokristallin cellulosa (PH 101), förgelatinerad stärkelse, röd järnoxid (E 172), natriumstearylfumarat;
5 mg tabletter: hypromelos, mikrokristallin cellulosa (PH 112), mikrokristallin cellulosa (PH 101), förgelatinerad stärkelse, gul järnoxid (E 172), natriumstearylfumarat;
10 mg tabletter: hypromelos, cellulosamikrokristall personlig (PH 112), mikrokristallin cellulosa (PH 101), förgelatinerad stärkelse, gul järnoxid (E 172), natriumstearylfumarat;
Doseringsform
Tabletter.
Grundläggande fysikaliska och kemiska egenskaper:
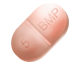
2,5 mg tabletter: rosa till röda prickiga tabletter, avlånga till formen, märkta R och 18 på båda sidor om fördelningslinjen på ena sidan av tabletten och med fördelningslinjen på den andra;
5 Altace receptfritt mg tabletter: ljusgula till gula prickiga tabletter, avlånga till formen, med beteckningen R och 19 på båda sidor om fördelningslinjen på ena sidan av tabletten och med fördelningslinjen på den andra;
10 mg tabletter: ljusgula till gula prickiga tabletter, avlånga till formen, med beteckningen R och 20 på båda sidor om fördelningslinjen på ena sidan av tabletten och med fördelningslinjen på den andra.
Farmakoterapeutisk grupp
Angiotensin-konverterande enzym (ACE)-hämmare, monokomponent. Ramipril.
ATS-kod C09A A05.
Farmakologiska egenskaper
Farmakodynamik.
Handlingsmekanism
Ramiprilat, den aktiva metaboliten av prodrugen ramipril, är en hämmare av enzymet dipeptidylkarboxipeptidas I (synonymer: angiotensin-omvandlande enzym; kinas II). I plasma och vävnader katalyserar detta enzym omvandlingen av angiotensin I till angiotensin II (a aktiv vasokonstriktor) och klyvning av den aktiva vasodilatorn bradykinin. En minskning av bildningen av angiotensin II och hämning av nedbrytningen av bradykinin leder till vasodilatation. Eftersom angiotensin II också stimulerar frisättningen av aldosteron leder ramiprilat till en minskning av aldosteronsekretionen. Svaret på monoterapi med ACE-hämmare var i genomsnitt mindre uttalat hos patienter av svart (afro-karibiskt ursprung) med arteriell hypertoni (en population som kännetecknas av låga reninnivåer vid hypertoni) än hos patienter av andra raser.
Antihypertensiva egenskaper
Mottagning av ramipril leder till en signifikant minskning av perifert arteriellt motstånd. Som regel finns det inga signifikanta förändringar i renalt plasmaflöde eller glomerulär filtrationshastighet. Utnämningen av ramipril till patienter med arteriell hypertoni leder till en minskning av blodtrycket i både den horisontella och vertikala positionen av patienten, vilket inte åtföljs av en kompenserande ökning av hjärtfrekvensen.
Hos de flesta patienter uppträder den antihypertensiva effekten 1-2 timmar efter oral administrering av en enda dos av läkemedlet. Den maximala effekten efter att ha tagit en engångsdos inträffar vanligtvis efter 3-6 timmar. Den antihypertensiva effekten efter att ha tagit en engångsdos kvarstår vanligtvis i 24 timmar.
Vid långtidsbehandling med ramipril är maximalt an antihypertensiv effekt utvecklas efter 3-4 veckor. Det har bevisats att med långtidsbehandling kvarstår den antihypertensiva effekten i 2 år.
Plötsligt utsättande av ramipril leder inte till en snabb och överdriven ökning av blodtrycket (rebound-fenomen).
Hjärtsvikt
Ramipril används som ett komplement till traditionell terapi med diuretika och, om nödvändigt, hjärtglykosider, och har visat sig vara effektivt hos patienter med NYHA funktionsklass II-IV hjärtsvikt. Läkemedlet Altace köpa har en gynnsam effekt på hjärthemodynamiken (reducerar fyllningstrycket i vänster och höger kammare, totalt perifert vaskulärt motstånd, ökad hjärtminutvolym och förbättrat hjärtindex). Det minskar också neuroendokrin aktivering.
Klinisk effekt och säkerhet
Förebyggande av hjärt-kärlsjukdomar / nefroskydd
En förebyggande placebokontrollerad studie (HOPE-studien) genomfördes på mer än 9 200 patienter som fick ramipril utöver standardterapi. Denna studie inkluderade patienter med hög risk för hjärt-kärlsjukdom efter tidigare aterotrombotisk hjärt-kärlsjukdom (historia av kranskärlssjukdom, stroke eller perifer vaskulär sjukdom) eller patienter med diabetes mellitus som hade minst en ytterligare riskfaktor (dokumenterad mikroalbuminuri, högt blodtryck, förhöjt totalkolesterol, lågdensitetslipoproteinkolesterol eller rökning).
Denna studie visade att ramipril statistiskt signifikant minskade incidensen av hjärtinfarkt, kardiovaskulär död och stroke, både ensamt och i kombination (primärt sammansatt effektmått).
Tabell 1. HOPE-studie: huvudresultat
| Index | Ramipril | placebo | Relativ risk (95% konfidensintervall) | p-värde |
| % | % | |||
| Alla patienter | n=4,645 | N=4,652 | ||
| Primär kombinerad endpoint | fjorton | 17.8 | < td style="width: 143px; höjd: 36px;">0,78 (0,7−0,86)<0,001 | |
| hjärtinfarkt | 9.9 | 12.3 | 0,80 (0,7–0,9) | <0,001 |
| Kardiovaskulär död | 6.1 | 8.1 | 0,74 (0,64–0,87) | <0,001 |
| Stroke | 3.4 | 4.9 | 0,68 (0,56–0,84) | <0,001 |
| Sekundära slutpunkter | ||||
| Död av någon anledning | 10.4 | 0,84 (0,75–0,95) | 0,005 | |
| Behov av revaskularisering | 16,0 | 18.3 | 0,85 (0,77–0,94) | 0,002 |
| Sjukhusinläggning för instabil angina | 12.1 | 12.3 | 0,98 (0,87–1,1) | inte pålitlig |
| Sjukhusinläggning för hjärtsvikt | 3.2 | 3.5 | 0,88 (0,7–1,1) | 0,25 |
| Komplikationer i samband med diabetes | 6.4 | 7.6 | 0,84 (0,72–0,98) | 0,03 |
MICRO-HOPE-studien, planerad som en del av HOPE-studien, undersökte effekten av att lägga till ramipril 10 mg till en befintlig behandlingsregim jämfört med placebo hos 3 577 patienter över 55 år (ingen övre åldersgräns) med normalt eller förhöjt blodtryck. varav de flesta hade typ 2-diabetes (och hade minst en kardiovaskulär riskfaktor).
Resultaten av den primära analysen visade att 117 (6,5%) studiedeltagare som fick ramipril och 149 (8,4%) som fick placebo utvecklade svår nefropati, vilket motsvarar en relativ riskminskning på 24%; 95% KI [3–40], p = 0,027.
REIN-studien, en multicenter, randomiserad, dubbelblind, placebokontrollerad, parallellgruppsstudie, genomfördes för att utvärdera effekten av ramiprilbehandling på graden av minskning av glomerulär filtrationshastighet (GFR) hos 352 patienter med normal eller förhöjd blodtryck (i åldern 18–70 år) som hade mild (genomsnittlig urinproteinutsöndring > 1 och < 3 g/dag) eller svår proteinuri (≥ 3 g/dag) på grund av kronisk icke-diabetisk nefropati. Båda undergrupperna var prospektivt stratifierade.
Resultaten av huvudanalysen av tillståndet hos patienter med den allvarligaste proteinurin (undergrupp, tidigt avbrytande av deltagande i studie, eftersom det fanns bevis för behandlingsnytta i ramiprilgruppen) visade att medelintensiteten av GFR-reduktion per månad var lägre med ramipril än med placebo: -0,54 (0,66) jämfört med -0,88 (1,03) ml/min/ månad, p = 0,038. Således var skillnaden mellan grupperna 0,34 [0,03–0,65] ml/min/månad och cirka 4 ml/min/år; 23,1% av patienterna i ramiprilgruppen uppnådde det kombinerade sekundära effektmåttet fördubbling av plasmakreatinin och/eller njursjukdom i slutstadiet (som behöver hemodialys eller njurtransplantation) jämfört med 45,5% i placebogruppen (p = 0, 02).
Dubbel blockad av renin-angiotensin-aldosteronsystemet (RAAS). Två stora randomiserade kontrollerade studier [ONTARGET (en studie av effekten av telmisartan ensamt och i kombination med ramipril på ett gemensamt effektmått) och VA NEPHRON-D (en studie av diabetisk nefropati hos veteraner)] studerade kombinationen av en ACE-hämmare med en antagon.
ONTARGET-studien utfördes på patienter med en historia av kardiovaskulär eller cerebrovaskulär sjukdom eller typ 2-diabetes mellitus med samtidiga tecken på målorganskada. VA NEPHRON-D-studien inkluderade patienter med typ 2-diabetes och diabetisk nefropati.
Dessa studier visade inte signifikanta fördelar av kombinationsbehandling i förhållande till och njur- och/eller kardiovaskulära konsekvenser och mortalitet, medan det fanns en ökad risk för hyperkalemi, akut njursvikt och/eller arteriell hypotension jämfört med monoterapi. Med tanke på de liknande farmakodynamiska egenskaperna hos dessa läkemedel gäller dessa resultat även andra ACE-hämmare och angiotensin II-receptorantagonister.
Därför bör ACE-hämmare och angiotensin II-receptorantagonister inte användas samtidigt hos patienter med diabetisk nefropati.
ALTITUDE-studien (Aliskiren Study on Type 2 Diabetes Using Cardiovascular and Renal Endpoints) utvärderade fördelarna med att lägga till aliskiren till standardbehandling med en ACE-hämmare eller angiotensin II-receptorantagonist hos patienter med kronisk njursjukdom, kardiovaskulär sjukdom eller båda. Denna studie avslutades tidigt på grund av en ökad risk för negativa kliniska resultat. I aliskirengruppen, jämfört med placebogruppen, fanns en högre incidens av dödsfall av kardiovaskulära orsaker och stroke, såväl som en ökning av frekvensen av allvarliga biverkningar av särskilt intresse (hyperkalemi, arteriell hypotoni och njurdysfunktion).
Sekundärprevention efter akut hjärtinfarkt. Mer än 2 000 patienter med transient/permanent symtom på hjärtsvikt efter hjärtinfarkt. Behandling med ramipril påbörjades 3–10 dagar efter uppkomsten av akut hjärtinfarkt. Denna studie visade att efter en medianuppföljningsperiod på 15 månader var mortaliteten 16,9% i ramiprilgruppen och 22,6% i placebogruppen. Detta innebär en absolut minskning av dödligheten med 5,7% och en relativ riskminskning på 27% (95% KI [11–40%)].
pediatrisk population. I en randomiserad, dubbelblind, placebokontrollerad klinisk studie på 244 pediatriska patienter med hypertoni (av vilka 73% hade primär hypertoni), i åldern 6 till 16 år, fick deltagarna låga, medelhöga eller höga doser ramipril för att uppnå plasmanivåer Ramiprilatkoncentrationer som motsvarar dosintervallet för vuxna på 1,25 mg; 5 och 20 mg baserat på kroppsvikt. I slutet av 4-veckorsperioden visade sig ramipril vara ineffektivt med avseende på slutpunkten för att sänka systoliskt blodtryck, men det minskade det diastoliska trycket vid den högsta dosen av studieområdet. Både medelstora och höga doser av ramipril har visat sig minska det systoliska och diastoliska blodtrycket med en statistiskt signifikant mängd hos barn med dokumenterad hypertoni.
Jag ser inte den här effekten. gavs i en 4-veckors, randomiserad, dubbelblind, dosökningsstudie som utvärderade effekten av läkemedelsabstinens hos 218 pediatriska patienter i åldern 6–16 år (av vilka 75% hade primär hypertoni). I denna studie observerades en måttlig rebound-ökning i både diastoliskt och systoliskt tryck efter utsättning av läkemedlet, men det var inte statistiskt signifikant för återgång av trycket till baslinjen i alla dosgrupper i studieområdet ramipril [låga doser (0,625) mg - 2,5 mg, medelstora doser (2,5 mg - 10 mg) eller höga doser (5 mg - 20 mg)] baserat på kroppsvikt. I den pediatriska studiepopulationen hade ramipril ingen linjär dosberoende effekt.
Farmakokinetik.
Sugning
Efter oral administrering absorberas ramipril snabbt från mag-tarmkanalen. Den maximala plasmakoncentrationen uppnås inom 1 timme. Med tanke på mängden av ämnet som finns i urinen är absorptionsgraden minst 56% och påverkar inte nämnvärt tillgången på mat i mag-tarmkanalen. Biotillgängligheten för den aktiva metaboliten av ramiprilat efter oral administrering i doser på 2,5 mg och 5 mg är 45%.
Den maximala plasmakoncentrationen av ramipril, den enda aktiva metaboliten av ramipril, uppnås 2-4 timmar efter att ha tagit ramipril. Efter konventionella doser av ramipr silt 1 gång per dag, uppnås jämviktskoncentrationen av ramiprilat i plasma ungefär den 4:e behandlingsdagen.
Distribution
Bindningen av ramipril till plasmaproteiner är cirka 73% och för ramiprilat är 56%.
Ämnesomsättning
Ramipril metaboliseras nästan fullständigt till ramiprilat, diketopiperazinester, diketopiperazinsyra och ramipril- och ramiprilatglukuronider.
föder upp
Utsöndring av metaboliter sker huvudsakligen genom renal utsöndring. Minskningen av plasmakoncentrationer av ramiprilat är multifasisk. På grund av dess starka mättande bindning till ACE och långsam dissociation från dess association med enzymet, har ramiprilat en förlängd terminal eliminationsfas vid mycket låga plasmakoncentrationer.
Efter att ha tagit upprepade doser av ramipril 1 gång per dag är den effektiva halveringstiden 13-17 timmar för doser på 5-10 mg och mer för låga doser (1,25-2,5 mg). Skillnaden beror på att enzymets förmåga att binda till ramiprilat är mättande.
När det togs oralt i en engångsdos upptäcktes varken ramipril eller dess metabolit i bröstmjölk. Det är dock inte känt vilken effekt upprepade doser har.
Patienter med nedsatt njurfunktion (se avsnittet "Administreringssätt och dosering")
Hos patienter med nedsatt njurfunktion är den renala utsöndringen av ramiprilat reducerad och renalt clearance av ramiprilat är proportionellt mot kreatininclearance. . Detta leder till en ökning av plasmakoncentrationen av ramiprilat, som minskar långsammare än hos individer med normal njurfunktion.
Patienter med nedsatt leverfunktion (se avsnittet "Appliceringsmetod och dosering")
Hos patienter med nedsatt leverfunktion bromsades metabolismen av ramipril till ramiprilat på grund av en minskning av aktiviteten av leveresteraser, och plasmanivåerna av ramipril hos dessa patienter ökade. De maximala koncentrationerna av ramiprilat hos dessa patienter skilde sig dock inte från dem hos individer med normal leverfunktion.
Laktation
Efter en oral engångsdos av ramipril låg nivåerna i bröstmjölk under detektionsgränsen. Effekten av upprepad användning är dock inte känd.
Pediatrisk population
Ramiprils farmakokinetiska profil studerades hos 30 pediatriska patienter med arteriell hypertoni i åldern 2–16 år som vägde mer än 10 kg. Efter doser på 0,05–0,2 mg/kg metaboliserades ramipril snabbt och omfattande till ramiprilat. Den maximala plasmakoncentrationen av ramiprilat uppnåddes efter 2-3 timmar. Clearance av ramiprilat var signifikant korrelerad med logaritmen av kroppsvikt (p < 0,01), såväl som med dosen av läkemedlet (p < 0,001). Clearance och distributionsvolym ökade i direkt proportion till åldern i varje dosgrupp. Vid en dos på 0,05 mg/kg uppnåddes EC-nivåer hos barn. exponeringar jämförbara med exponering hos vuxna vid användning och doser på 5 mg ramipril. Som ett resultat av användningen av en dos på 0,2 mg/kg hos barn uppnåddes exponeringsnivåer som var högre än vid användning av den maximala rekommenderade dosen på 10 mg/dag hos vuxna.
Prekliniska säkerhetsdata
Vid oral administrering till gnagare och hundar visade det sig att ramipril inte orsakar akuta toxiska effekter. En studie med långvarig oral administrering av läkemedlet genomfördes på råttor, hundar och apor. Hos alla dessa tre djurarter observerades förändringar i elektrolytbalans och blodmönster. Hos hundar och apor som behandlades med läkemedlet i en dos av 250 mg / kg kroppsvikt per dag noterades en signifikant ökning av den juxtaglomerulära apparaten, vilket är en manifestation av ramiprils farmakodynamiska aktivitet. Råttor, hundar och apor tolererade dagliga doser av 2; 2,5 respektive 8 mg/kg kroppsvikt per dag. Samtidigt hade de inga oönskade effekter.
Reproduktionstoxicitetsstudier utförda på råttor, kaniner och apor visade inte några teratogena egenskaper hos läkemedlet. Negativa effekter på fertiliteten observerades inte hos varken han- eller honråttor.
Administrering av ramipril till honråttor under dräktighet och laktation resulterade i irreversibel njurskada (utvidgning av njurbäckenet) hos avkomma vid doser på 50 mg/kg kroppsvikt per dag och över.
Många mutagenitetstester med olika x testsystem avslöjade inte mutagena eller genotoxiska egenskaper hos ramipril.
Kliniska egenskaper
Indikationer
Behandling av arteriell hypertoni.
Förebyggande av kardiovaskulär sjukdom: minskning av kardiovaskulär sjuklighet och dödlighet hos patienter med:
- allvarlig kardiovaskulär sjukdom av aterotrombotiskt ursprung (historia av kranskärlssjukdom eller stroke eller perifer kärlsjukdom);
- diabetes om patienten har minst en kardiovaskulär riskfaktor (se avsnittet "Farmakologiska egenskaper").
Behandling av njursjukdom:
- initial glomerulär diabetisk nefropati, vilket framgår av närvaron av mikroalbuminuri;
- svår glomerulär diabetisk nefropati, vilket framgår av närvaron av makroproteinuri, hos patienter som har minst en kardiovaskulär riskfaktor (se avsnittet "Farmakologiska egenskaper");
- allvarlig glomerulär icke-diabetisk nefropati, vilket framgår av närvaron av makroproteinuri ≥ 3 g/dag (se avsnittet "Farmakologiska egenskaper").
Behandling av hjärtsvikt, åtföljd av kliniska manifestationer.
Sekundär prevention efter akut hjärtinfarkt: minskning av dödligheten under det akuta stadiet av hjärtinfarkt hos patienter med kliniska tecken på hjärta leversvikt när behandlingen påbörjas mer än 48 timmar efter uppkomsten av akut hjärtinfarkt.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något av hjälpämnena som utgör läkemedlet, eller mot andra ACE-hämmare (angiotensinomvandlande enzym) (se avsnittet "Komposition").
En historia av angioödem (ärftligt, idiopatiskt eller tidigare överfört till bakgrunden av användningen av ACE-hämmare eller angiotensin II-receptorantagonister).
Samtidig användning med sacubitril/valsartan (se avsnitten "Särdragen vid användning" och "Interaktion med andra läkemedel och andra typer av interaktioner").
Betydande bilateral njurartärstenos eller njurartärstenos i närvaro av en enda fungerande njure.
Graviditet och graviditetsplanering (se avsnittet "Användning under graviditet och amning").
Ramipril ska inte användas till patienter med arteriell hypotoni eller hemodynamiskt instabila tillstånd.
Samtidig användning av Laceran med läkemedel som innehåller aliskiren är kontraindicerat hos patienter med diabetes mellitus eller nedsatt njurfunktion (glomerulär filtrationshastighet (GFR) < 60 ml/min/1,73 m2) (se avsnitten "Interaktioner med andra läkemedel och andra typer av interaktioner" och farmakodynamik).
Det är nödvändigt att undvika samtidig användning av ACE-hämmare och extrakorporeala terapier som leder till blodkontakt med negativt laddade ytor (se avsnittet "Interaktion med andra läkemedel och andra typer av interaktioner").
Interaktion med andra läkemedel och andra former av interaktion
Data från kliniska studier har visat att dubbel blockad av renin-angiotensin-aldosteronsystemet (RAAS) genom kombinerad användning av ACE-hämmare, angiotensin II-receptorantagonister eller aliskiren är associerad med en ökad förekomst av biverkningar såsom arteriell hypotoni och försämring njurfunktionen (inklusive akut njursvikt), jämfört med användningen av endast ett medel som påverkar RAAS (se avsnitten "Kontraindikationer", "Särskildheter vid användning" och "Farmakodynamik").
Kontraindicerade kombinationer
Samtidig användning av ACE-hämmare och sacubitril/valsartan är kontraindicerad på grund av en ökad risk för att utveckla angioödem (se avsnitten "Kontraindikationer" och "Särskildheter vid användning"). Behandling med ramipril bör påbörjas 36 timmar efter den sista dosen av sacubitril/valsartan. Behandling med sacubitril/valsartan bör påbörjas 36 timmar efter den sista dosen av ramipril.
Extrakorporeala metoder behandlingar som bringar blod i kontakt med negativt laddade ytor, såsom dialys eller hemofiltrering med vissa högflödesmembran (som polyakrylnitrilmembran) och lipoproteinaferes med låg densitet med dextransulfat, givet den ökade risken för allvarliga anafylaktoida reaktioner (se "Kontraindikationer" "). Om sådan behandling är nödvändig bör man överväga att använda ett annat dialysmembran eller annan klass av antihypertensiva medel.
Kombinationer som kräver försiktighetsåtgärder
Kaliumsalter, heparin, kaliumsparande diuretika och andra aktiva substanser som ökar nivån av kalium i blodplasman (inklusive angiotensin II-antagonister, trimetoprim och dess fasta kombinationer med sulfametoxazol, takrolimus, ciklosporin). Hyperkalemi kan förekomma, så plasmakaliumnivåerna måste övervakas noggrant.
Antihypertensiva läkemedel (t.ex. diuretika) och andra substanser som kan sänka blodtrycket (t.ex. nitrater, tricykliska antidepressiva medel, anestetika, alkohol, baklofen, alfuzosin, doxazosin, prazosin, tamsulosin, terazosin). En ökning av risken för arteriell hypotoni bör förväntas (se avsnittet "Särskildheter vid användning" i samband med diuretika).
Vasopressor sympatomimetika och andra substanser (t.ex. isoproterenol, dobutamin, dopa min, epinefrin), vilket kan minska den antihypertensiva effekten av Laceran. Det rekommenderas att noggrant övervaka blodtrycket.
Alopurinol, immunsuppressiva medel, kortikosteroider, prokainamid, cytostatika och andra ämnen som kan leda till förändringar i blodbilden. Ökad sannolikhet för hematologiska reaktioner (se avsnittet "Särskildheter vid användning").
Litiumsalter. ACE-hämmare kan minska litiumutsöndringen, vilket kan leda till ökad litiumtoxicitet. Litiumnivåer måste övervakas noggrant.
Antidiabetika, inklusive insulin. Hypoglykemiska reaktioner kan förekomma. Det rekommenderas att noggrant övervaka blodsockernivåerna.
Icke-steroida antiinflammatoriska läkemedel (NSAID) och acetylsalicylsyra. En minskning av den antihypertensiva effekten av läkemedlet Laceran förväntas. Dessutom kan samtidig användning av ACE-hämmare och NSAID åtföljas av en ökad risk för försämring av njurfunktionen och en ökning av kaliumnivån i blodet.
Salt. Med överdrivet saltintag kan den hypotensiva effekten av läkemedlet försvagas.
Specifik hyposensibilisering. Som ett resultat av ACE-hämning ökar sannolikheten och svårighetsgraden för anafylaktiska och anafylaktoida reaktioner på insektsgift. Man tror att denna effekt även kan observeras i förhållande till andra allergener.
Däggdjurs målinhibitorer av rapamycin (mTOR) eller vildagliptin. Det är möjligt att öka ri ska utveckling av angioödem hos patienter som samtidigt får läkemedel såsom mTOR-hämmare (t.ex. temsirolimus, everolimus, sirolimus) eller vildagliptin. Fortsätt till sådan terapi med försiktighet (se avsnittet "Särskildheter vid användning").
Racecadotril. En potentiell ökning av risken för att utveckla angioödem har rapporterats vid samtidig användning av ACE-hämmare och en hämmare av NEP (neutralt endopeptidas), såsom racekadotril (se avsnittet "Särskildheter vid användning").
Sacubitril/valsartan. Samtidig användning av ACE-hämmare och sacubitril/valsartan är kontraindicerad på grund av en ökad risk för angioödem.
Applikationsfunktioner
Särskilda patientgrupper
Graviditet. Altace Sverige Behandling med ACE-hämmare eller angiotensin II-receptorantagonister bör inte påbörjas under graviditet. Om inte fortsatt behandling med en ACE-hämmare/angiotensin II-receptorantagonist är absolut nödvändig, ska patienter som planerar att bli gravida byta till ett annat blodtryckssänkande läkemedel som anses säkert att använda under graviditet. Så snart graviditet har diagnostiserats ska behandling med ACE-hämmare/angiotensin II-receptorantagonister avbrytas omedelbart och vid behov bör behandling med ett annat läkemedel påbörjas (se avsnitten "Kontraindikationer" och "Användning under graviditet eller amning).
Dubbel blockad av renin-angiotensin-aldosteronsystemet (RAAS). Det finns bevis för det faktum att samtidig användning av ACE-hämmare, angiotensin II-receptorantagonister eller aliskiren ökar risken för arteriell hypotoni, hyperkalemi och försämring av njurfunktionen (inklusive utveckling av akut njursvikt). I detta avseende rekommenderas inte dubbel blockad av RAAS genom kombinerad användning av ACE-hämmare, angiotensin II-receptorantagonister eller aliskiren (se avsnitten "Interaktion med andra läkemedel och andra former av interaktion" och "Farmakodynamik").
Om behandling i form av en sådan dubbel blockad anses vara absolut nödvändig, bör den endast användas under överinseende av en specialist och med frekvent och noggrann övervakning av njurfunktion, elektrolyter och blodtrycksnivåer.
ACE-hämmare och angiotensin II-receptorantagonister ska inte användas samtidigt hos patienter med diabetisk nefropati.
Patienter med särskild risk för arteriell hypotoni
Patienter med en signifikant ökning av aktiviteten hos renin-angiotensin-aldosteronsystemet. Patienter med en signifikant ökning av aktiviteten hos renin-angiotensin-aldosteronsystemet riskerar att drabbas av en plötslig signifikant minskning av blodtrycket och försämring av njurfunktionen på grund av ACE-hämning, särskilt om en ACE-hämmare eller samtidig medicinering urinröret ordineras för första gången eller dosen ökas för första gången. En signifikant ökning av aktiviteten hos renin-angiotensin-aldosteronsystemet, som kräver medicinsk övervakning, inklusive konstant övervakning av blodtrycket, kan förväntas, till exempel hos patienter:
- med svår arteriell hypertoni;
- med dekompenserad kongestiv hjärtsvikt;
- med ett hemodynamiskt signifikant hinder för inflödet eller utflödet av blod från vänster ventrikel (till exempel med stenos av aorta- eller mitralisklaffen);
- med ensidig stenos av njurartären i närvaro av en andra fungerande njure;
- som har eller kan utveckla brist på vätska eller elektrolyter (inklusive de som får diuretika);
- med cirros i levern och / eller ascites;
- som utför större operationer eller under anestesi med användning av läkemedel som orsakar arteriell hypotoni.
Som regel rekommenderas att korrigera uttorkning, hypovolemi eller brist på elektrolyter innan behandlingen påbörjas (dock för patienter med hjärtsvikt bör sådana korrigerande åtgärder noggrant vägas mot risken för volymöverbelastning).
Övergående eller ihållande hjärtsvikt efter hjärtinfarkt.
Patienter med risk för hjärt- eller cerebral ischemi vid akut arteriell hypotoni. I den inledande fasen av behandlingen krävs särskild medicinsk övervakning.
En patient s av hög ålder. Se avsnittet "Administreringssätt och dosering".
Kirurgiskt ingrepp. Om möjligt bör behandling med angiotensinomvandlande enzymhämmare såsom ramipril avbrytas 1 dag före operationen.
Kontroll av njurfunktionen. Njurfunktionen bör utvärderas före Altace pris och under behandlingen och dosjusteringar bör göras, särskilt under de första veckorna av behandlingen. Särskilt noggrann övervakning är nödvändig för tillståndet hos patienter med nedsatt njurfunktion (se avsnittet "Appliceringsmetod och doser"). Det finns en risk för försämring av njurfunktionen, särskilt hos patienter med kronisk hjärtsvikt eller efter njurtransplantation, samt vid njurkärlsjukdom, inklusive hos patienter med hemodynamiskt signifikant unilateral njurartärstenos.
Angioödem. Hos patienter som behandlats med ACE-hämmare, inklusive ramipril, observerades angioödem (se avsnittet "Biverkningar"). Denna risk är ökad hos patienter som samtidigt får läkemedel som rapamycinhämmare (mTOR) från däggdjur (t.ex. temsirolimus, everolimus, sirolimus) eller vildagliptin eller racekadotril.
Kombinationen av ramipril och sacubitril/valsartan är kontraindicerad på grund av en ökad risk för angioödem (se avsnitten "Kontraindikationer" och "Interaktioner med andra läkemedel och andra former av interaktioner" aquo ;).
Vid angioödem ska användningen av Laceran avbrytas. Du måste påbörja akutbehandling omedelbart. Patienten ska vara under kontroll i minst 12-24 timmar och kan skrivas ut efter fullständigt upphörande av symtomen.
Hos patienter som behandlats med ACE-hämmare, inklusive Laceran, observerades fall av angioödem i tarmen (se avsnittet "Biverkningar"). Dessa patienter klagade över buksmärtor (med eller utan illamående eller kräkningar).
Anafylaktiska reaktioner under desensibilisering. Med användning av ACE-hämmare ökar sannolikheten och svårighetsgraden av anafylaktiska och anafylaktoida reaktioner på insektsgift och andra allergener. Före desensibilisering bör du tillfälligt sluta ta läkemedlet Laceran.
Kontroll av elektrolytbalansen. Hyperkalemi. Hyperkalemi har observerats hos vissa patienter som behandlats med ACE-hämmare, inklusive Laceran. Riskgruppen för hyperkalemi inkluderar patienter med njurinsufficiens, patienter över 70 år, patienter med okontrollerad diabetes mellitus, patienter som tar kaliumsalter, kaliumsparande diuretika samt andra aktiva substanser som ökar kaliumhalten i blodplasman , eller patienter med sådana tillstånd som uttorkning, akut hjärtdekompensation, metabol acidos. Om den kombinerade användningen av ovanstående läkemedel anses lämplig, då floderna Det rekommenderas att regelbundet övervaka kaliumnivån i blodplasman (se avsnittet "Interaktioner med andra läkemedel och andra typer av interaktioner").
Kontroll av elektrolytbalansen. Hyponatremi. Hos vissa patienter som behandlades med ramipril förekom ett syndrom med olämplig utsöndring av antidiuretiskt hormon med utveckling av hyponatremi. Det rekommenderas att regelbundet övervaka natriumnivåer i serum hos äldre och andra patienter som riskerar att utveckla hyponatremi.
Neutropeni/Agranulocytos. Fall av neutropeni/agranulocytos, såväl som trombocytopeni och anemi, var sällsynta. Benmärgssuppression har också rapporterats. För att upptäcka eventuell leukopeni rekommenderas det att övervaka antalet leukocyter i blodet. Tätare övervakning är önskvärt i början av behandlingen och för patienter med nedsatt njurfunktion, samtidig kollagenos (till exempel systemisk lupus erythematosus eller sklerodermi), eller de som tar andra läkemedel som kan orsaka förändringar i blodbilden (se avsnitten "Interaktion med andra läkemedelsmedel och andra typer av interaktioner” och “Biverkningar”).
etniska skillnader. ACE-hämmare är mer benägna att orsaka angioödem hos patienter av den svarta rasen än hos andra raser. Liksom andra ACE-hämmare kan den hypotensiva effekten av ramipril vara mindre uttalad hos patienter av den svarta rasen jämfört med representanter för en annan. deras raser. Detta kan bero på att svarta patienter med arteriell hypertoni är mer benägna att ha arteriell hypertoni med låg reninaktivitet.
Hosta. Hosta har rapporterats vid användning av ACE-hämmare. Det är karakteristiskt att hostan är improduktiv, långvarig och försvinner efter avslutad behandling. Vid differentialdiagnos av hosta bör man vara medveten om möjligheten till hosta på grund av användning av ACE-hämmare.
Används under graviditet eller amning
Graviditet
Läkemedlet är kontraindicerat för gravida kvinnor eller kvinnor som planerar att bli gravida. Om graviditet konstateras under behandlingen ska läkemedlet avbrytas omedelbart och vid behov ersättas med ett annat läkemedel som är godkänt för användning (se avsnittet "Kontraindikationer").
Laktation
På grund av bristen på information om användningen av ramipril under amning (se avsnittet "Farmakologiska egenskaper"), rekommenderas det inte att förskriva detta läkemedel till kvinnor som ammar, och det är önskvärt att ge företräde åt andra läkemedel, användning av som under amning är säkrare, speciellt när det är bröstet. mata nyfödda eller för tidigt födda barn.
Förmågan att påverka reaktionshastigheten när du kör fordon eller använder andra mekanismer
Vissa biverkningar (som symtom vi sänker blodtrycket, som yrsel) kan försämra patientens koncentrationsförmåga och minska hastigheten på hans reaktion, vilket är riskabelt i situationer där dessa egenskaper är särskilt viktiga (till exempel när man kör fordon eller arbetar med andra mekanismer).
Detta är vanligtvis möjligt i början av behandlingen eller när man byter från behandling med andra läkemedel till behandling med Laceran. Efter att ha tagit den första dosen eller efterföljande dosökning är det inte tillrådligt att köra fordon eller arbeta med andra mekanismer i flera timmar.
Dosering och administrering
Förberedelse för oral administrering.
Läkemedlet Laceran rekommenderas att tas dagligen samtidigt. Läkemedlet kan tas före, under och efter måltider, eftersom födointag inte påverkar läkemedlets biotillgänglighet. Laceran tabletter ska sväljas hela med vatten. De får inte tuggas eller krossas.
Om det är omöjligt att använda den föreskrivna dosen, använd ramipril i lämplig dos.
vuxna
Patienter som använder diuretika. I början av behandlingen med Laceran kan arteriell hypotension förekomma, vars utveckling är mer sannolikt hos patienter som samtidigt får diuretika. I sådana fall rekommenderas det att vara försiktig, eftersom dessa patienter kan ha en minskning av BCC och/eller mängden elektrolyter.
Om möjligt är det lämpligt att sluta att använda ett diuretikum 2-3 dagar innan behandlingen med Laceran påbörjas (se avsnittet "Särskildheter vid användning").
Hos patienter med arteriell hypertoni som inte kan stoppa diuretikumet ska behandling med Laceran börja med en dos på 1,25 mg (använd ramipril i lämplig dos). Njurfunktion och blodkaliumnivåer bör övervakas noggrant. Ytterligare dosering av läkemedlet Laceran bör justeras beroende på målnivån för blodtrycket.
Arteriell hypertoni
Dosen bör väljas individuellt beroende på egenskaperna hos patientens tillstånd (se avsnittet "Särskildheter vid användning") och resultaten av kontrollmätningar av blodtrycket. Laceran kan användas som monoterapi eller i kombination med andra klasser av blodtryckssänkande läkemedel (se avsnitten "Kontraindikationer", "Användningsegenskaper", "Interaktion med andra läkemedel och andra typer av interaktioner" och "Farmakodynamik").
Initial dosering. Behandling med Laceran bör startas gradvis, med början med den rekommenderade initiala dosen på 2,5 mg (med ramipril i lämplig dos) per dag.
Hos patienter med signifikant aktivering av renin-angiotensin-aldosteronsystemet efter att ha tagit den initiala dosen kan en signifikant sänkning av blodtrycket inträffa. För sådana patienter är den rekommenderade startdosen 1,25 mg (använd ram ipril i lämplig dos), och deras behandling bör påbörjas under kontroll billig Altace (se avsnittet "Särskildheter vid användning").
Dostitrering och underhållsdos. Dosen kan fördubblas varannan till var fjärde vecka tills målblodtrycket uppnås; Den maximala dosen av Laceran är 10 mg/dag. Som regel tas läkemedlet 1 gång per dag.
Förebyggande av hjärt-kärlsjukdomar
Initial dosering. Den rekommenderade startdosen av Laceran är 2,5 mg (använd ramipril i lämplig dos) en gång dagligen.
Dostitrering och underhållsdos. Beroende på läkemedlets individuella tolerabilitet bör dosen ökas gradvis. Det rekommenderas att dosen fördubblas efter 1–2 veckors behandling och sedan ökas till målunderhållsdosen på 10 mg en gång dagligen efter 2–3 veckor.
Behandling av njursjukdom
Patienter med diabetes och mikroalbuminuri
Initial dosering. Den rekommenderade initialdosen av Laceran är 1,25 mg (använd ramipril i lämplig dos) en gång dagligen.
Dostitrering och underhållsdos. Beroende på läkemedlets individuella tolerabilitet under fortsatt behandling, ökas dosen. Efter 2 veckors behandling rekommenderas en enstaka daglig dos att fördubblas till 2,5 mg (med ramipril i lämplig dos) och sedan till 5 mg efter 2 veckors behandling.
Patienter med diabetes och minst en kardiovaskulär riskfaktor om risk
Initial dosering. Den rekommenderade startdosen av Laceran är 2,5 mg (använd ramipril i lämplig dos) en gång dagligen.
Dostitrering och underhållsdos. Beroende på läkemedlets individuella tolerabilitet under fortsatt behandling, ökas dosen. Efter 1-2 veckors behandling rekommenderas den dagliga dosen av Laceran att fördubblas till 5 mg och sedan till 10 mg efter 2-3 veckors behandling. Den dagliga måldosen är 10 mg.
Patienter med icke-diabetisk nefropati, vilket framgår av närvaron av makroproteinuri ≥ 3 g per dag
Initial dosering. Den rekommenderade initialdosen av Laceran är 1,25 mg (använd ramipril i lämplig dos) en gång dagligen.
Dostitrering och underhållsdos. Beroende på patientens individuella tolerans av läkemedlet under fortsatt behandling, ökas dosen. Efter 2 veckors behandling rekommenderas en enstaka daglig dos att fördubblas till 2,5 mg (med ramipril i lämplig dos) och sedan till 5 mg efter 2 veckors behandling.
Hjärtsvikt med kliniska manifestationer
Initial dosering. För patienter vars tillstånd har stabiliserats efter behandling med diuretika är den rekommenderade initialdosen 1,25 mg (använd ramipril i lämplig dos) per dag.
Dostitrering och underhållsdos. Dosen av Laceran titreras genom att den fördubblas var 1-2:e vecka tills en maximal daglig dos på 10 mg uppnås. Önskvärd o dela upp dosen i 2 doser.
Sekundärprevention efter akut hjärtinfarkt i närvaro av hjärtsvikt
Initial dosering. 48 timmar efter uppkomsten av hjärtinfarkt, ordineras patienter vars tillstånd är kliniskt och hemodynamiskt stabilt en initial dos på 2,5 mg (använd ramipril i lämplig dos) 2 gånger om dagen i 3 dagar. Om startdosen på 2,5 mg (använd ramipril i lämplig dos) inte tolereras väl, bör en dos på 1,25 mg användas (använd ramipril i lämplig dos). 2 gånger om dagen i 2 dagar, följt av en ökning till 2,5 mg (använd ramipril i lämplig dos) och 5 mg 2 gånger om dagen. Om dosen inte kan ökas till 2,5 mg (använd ramipril i lämplig dos) 2 gånger om dagen, ska behandlingen avbrytas.
Dostitrering och underhållsdos. I framtiden ökas den dagliga dosen genom att dubbla den med ett intervall på 1-3 dagar tills målunderhållsdosen på 5 mg 2 gånger om dagen uppnås.
När det är möjligt delas den dagliga underhållsdosen upp i 2 doser.
Om dosen inte kan ökas till 2,5 mg (använd ramipril i lämplig dos) 2 gånger om dagen, ska behandlingen avbrytas. Det finns fortfarande otillräcklig erfarenhet av behandling av patienter med svår (New York Heart Association (NYHA) funktionell klass IV) hjärtsvikt omedelbart efter hjärtinfarkt. Om beslut fattas om att behandla sådana patienter med detta läkemedel rekommenderas att starta behandlingen med en dos på 1,25 mg (använd ramipril i lämplig dos) 1 gång per dag och eventuell ökning av den bör utföras med extrem försiktighet.
Särskilda kategorier av patienter
Patienter med nedsatt njurfunktion. Den dagliga dosen för patienter med nedsatt njurfunktion beror på kreatininclearance (se avsnittet "Farmakologiska egenskaper"):
- om kreatininclearance är ≥ 60 ml/min, finns det inget behov av att justera startdosen (2,5 mg/dag (använd ramipril i lämplig dos)) och den maximala dagliga dosen är 10 mg;
- om kreatininclearance är 30-60 ml/min, finns det inget behov av att justera startdosen (2,5 mg/dag (använd ramipril i lämplig dos)) och den maximala dagliga dosen är 5 mg;
- om kreatininclearance är 10-30 ml/min, är den initiala dagliga dosen 1,25 mg/dag (använd ramipril i lämplig dos), och den maximala dagliga dosen är 5 mg;
- patienter med arteriell hypertoni som är i hemodialys: med hemodialys utsöndras ramipril något; startdosen är 1,25 mg (använd ramipril i lämplig dos), och den maximala dagliga dosen är 5 mg; Läkemedlet bör tas några timmar efter hemodialystillfället.
Patienter med nedsatt leverfunktion (se avsnittet "Farmakologiska egenskaper"). L behandling med Laceran hos patienter med nedsatt leverfunktion bör påbörjas under noggrann övervakning, och den maximala dagliga dosen i sådana fall bör vara 2,5 mg (använd ramipril i lämplig dos).
Äldre patienter. Initialdosen bör vara lägre och efterföljande dostitrering bör utföras mer gradvis, med hänsyn till den högre sannolikheten för biverkningar, särskilt hos mycket gamla och svaga patienter. I sådana fall bör en lägre initial dos på 1,25 mg ramipril förskrivas (använd ramipril i lämplig dos).
Se även doseringsinformationen ovan för patienter som får diuretika.
Barn
Läkemedlet Laceran rekommenderas inte för användning till barn (under 18 år), eftersom data om detta läkemedels effekt och säkerhet för sådana patienter inte räcker.
Överdos
Symtom associerade med en överdos av ACE-hämmare kan vara överdriven perifer vasodilatation (med svår arteriell hypotoni, chock), bradykardi, elektrolytobalans och njursvikt. Patientens tillstånd bör övervakas noggrant och symtomatisk och stödjande behandling bör utföras. De föreslagna terapeutiska åtgärderna inkluderar primär avgiftning (magsköljning, införande av adsorbenter), samt åtgärder som syftar till att återställa en stabil blödning. dynamik, inklusive administrering av α1-adrenerga receptoragonister eller angiotensin II (angiotensinamid). Ramiprilat, den aktiva metaboliten av ramipril, utsöndras dåligt från den systemiska cirkulationen genom hemodialys.
Negativa reaktioner
Säkerhetsprofilen för läkemedlet Laceran innehåller data om ihållande hosta och reaktioner orsakade av arteriell hypotoni. Allvarliga biverkningar inkluderar angioödem, hyperkalemi, lever- eller njurdysfunktion, pankreatit, allvarliga hudreaktioner och neutropeni/agranulocytos.
Frekvensen av biverkningar klassificeras enligt följande: mycket ofta (≥ 1/10); ofta (från ≥ 1/100 till < 1/10); sällan (från ≥ 1/1000 till < 1/100); sällan (från ≥ 1/10 000 till < 1/1 000); mycket sällsynt (< 1/10 000), okänd (kan inte beräknas utifrån tillgängliga data). I varje grupp presenteras biverkningarna i fallande ordning efter svårighetsgrad.
Tabell 2.
| Organsystem klass | Biverkningar efter frekvens | ||||
| Ofta | Sällan | Sällan | Väldigt sällan | okänd | |
| Hjärtsjukdomar | |||||
| Störningar i blodet och lymfsystemet | Eosinofili | Minskat antal vita blodkroppar (inklusive neutropeni eller agranulocytos), minskat antal röda blodkroppar, minskat hemoglobin, minskat antal trombocyter | Benmärgssvikt, pancytopeni, hemolytisk anemi | ||
| Störningar från nervsystemet | Huvudvärk, yrsel | Vertigo, parestesi, ageusi, dysgeusi | Tremor, obalans | Cerebral ischemi, inklusive ischemisk stroke och övergående ischemisk attack; kränkning av psykomotoriska funktioner; brännande känsla; parosmi | |
| Störningar i synorganen | Synstörningar, inklusive dimsyn | Konjunktivit | |||
| Störningar i hörselorganen och labyrinten | Hörselnedsättning, ljud/ringningar i öronen | ||||
| Andningsvägar, bröstkorg och mediastinum | Improduktiv irritabel hosta, bronkit, bihåleinflammation, andnöd | Bronkospasm, inklusive exacerbation av astma; nästäppa | |||
| Gastrointestinala störningar | Inflammatoriska fenomen i mag-tarmkanalen, matsmältningsbesvär, bukbesvär, dyspepsi, diarré, illamående, kräkningar | Pankreatit (i sällsynta fall har dödsfall rapporterats uteslutande med användning av ACE-hämmare), ökade nivåer av pankreasenzymer, angioödem i tunntarmen, smärta i övre delen av buken, inklusive de som är associerade med gastrit, förstoppning, muntorrhet | Glossit | Aftös stomatit | |
| Russ trillingar från njurarna och urinvägarna | Nedsatt njurfunktion, inklusive akut njursvikt; ökad urinering, försämring av bakgrundsproteinuri, ökade nivåer av urea i blodet; ökning av kreatinin i blodet | ||||
| Hud och subkutan vävnad | Utslag, särskilt makulopapulära | Angioödem, i mycket undantagsfall, luftvägsobstruktion på grund av angioödem, vilket kan vara dödligt; klåda, hyperhidros | Exfoliativ dermatit, urtikaria, onykolys | ljuskänslighetsreaktion | Toxisk epidermal nekrolys, Stevens-Johnsons syndrom, erythema multiforme, pemfigus, exacerbation av psoriasis, psoriasis dermatit, pemfigoid eller lichenoid exanthem eller enanthema, alopeci |
| Muskuloskeletala och bindvävssjukdomar | Muskelspasmer, myalgi | Artralgi | |||
| endokrina störningar | Syndrom av olämplig utsöndring av antidiuretiskt hormon (SIAH) | ||||
| Metaboliska och näringsmässiga störningar | Öka nivån av kalium i blodet | Anorexi, aptitlöshet | Minskade natriumnivåer i blodet | ||
| Vaskulära störningar | Arteriell hypotoni, ortostatisk blodtryckssänkning, synkope | Känner av tidvattnet | Vaskulär stenos, hypoperfusion, vaskulit | Raynaud-fenomen | |
| Allmäntillståndsstörningar | Bröstsmärtor, trötthet | pyrexi | Asteni | ||
| Immunsystemets störningar | Anafylaktiska och anafylaktoida reaktioner, ökade nivåer av antinukleära antikroppar | ||||
| Lever och gallvägar | Förhöjda leverenzymer och/eller konjugerat bilirubin | Kolestatisk gulsot, levercellsskada | Akut leversvikt, kolestatisk eller cytolytisk hepatit (mycket undantagsvis dödlig) | ||
| Störningar i reproduktionssystemet och bröstkörtlar | Övergående erektil impotens, minskad libido | Gynekomasti | |||
| Mentala störningar | Nedsatt humör, ångest, nervositet, rastlöshet, sömnstörningar inklusive dåsighet | Det förvirrade medvetandets läger | Uppmärksamhetsstörning | ||
pediatrisk population. Säkerheten av ramipril studerades hos 325 barn och ungdomar i ålder 2-16 år i 2 kliniska studier. Enligt resultaten liknade arten och svårighetsgraden av biverkningar hos barn de som observerades hos vuxna, men frekvensen av förekomsten av vissa reaktioner hos barn var högre än hos vuxna, nämligen:
takykardi, nästäppa och rinit: vanliga (dvs. ≥ 1/100 till < 1/10) hos den pediatriska populationen och sällsynta (dvs. ≥ 1/1000 till < 1/100) hos vuxna patienter;
konjunktivit: vanlig (dvs. ≥ 1/100 till < 1/10) hos den pediatriska populationen och sällsynt (dvs. ≥ 1/10 000 till < 1/1 000) hos vuxna;
tremor och urtikaria: sällsynta (dvs. ≥ 1/1000 till < 1/100) hos den pediatriska populationen och sällsynta (dvs. ≥ 1/10 000 till < 1/1000) hos vuxna patienter.
Den övergripande säkerhetsprofilen för ramipril hos barn och vuxna skiljer sig inte signifikant.
Rapporter om misstänkta biverkningar.
Rapportering efter registrering av misstänkta biverkningar är en viktig åtgärd. De möjliggör fortsatt övervakning av nytta/risk-förhållandet för läkemedlet.
Läkare bör rapportera fall av eventuella biverkningar med hjälp av Ukrainas system för säkerhetsövervakning.
Bäst före datum
2 år.
Lagringsförhållanden
Förvaras i originalförpackningen, vid en temperatur som inte överstiger 25 °C, utom räckhåll för barn.
Packning< /strong>
7 tabletter i en blisterförpackning; 2 eller 4 blåsor i en kartong.
Semesterkategori
På recept.
Tillverkare
Sun Pharmaceutical Industries Limited.
Sun Pharmaceutical Industries Limited.
Tillverkarens plats och adress till affärsstället
Med. Gangwala, Paonta Sahib, Sirmour District, Himachal Pradesh 173025, Indien.
V. Ganguwala, Paonta Sahib, District Sirmour, Himachal Pradesh 173025, Indien.